Corticosteroïde

AservoMC EquihalerMC est un inhalateur-doseur non pressurisé qui libère une bruine de médicament. La cartouche contient une solution à 30 mg/mL du pro-médicament ciclésonide. Le pro-médicament ciclésonide est converti par voie enzymatique en desisobutyryl-ciclésonide (des-ciclésonide), métabolite actif au plan pharmacologique suivant l'inhalation.

Pour la prise en charge des signes cliniques associés à l'asthme équin grave chez les chevaux.

Solution de ciclésonide pour inhalation, 343 mcg par pulvérisation.

Pour inhalation intranasale seulement. AservoMC EquihalerMC peut être utilisé dans le cadre d'un programme de prise en charge globale de l'asthme équin grave en association avec d'autres stratégies appropriées pour maîtriser les signes cliniques, telles que l'apport de changements environnementaux et le traitement bronchodilatateur, au besoin.
La dose initiale d'AservoMC EquihalerMC est de 8 pulvérisations (2 744 mcg de ciclésonide) deux fois par jour pendant 5 jours, suivies de 12 pulvérisations (4 116 mcg de ciclésonide) une fois par jour pendant 5 jours.
| La durée totale du traitement est de 10 jours. | |
| Jours de traitement 1 à 5 |
Jours de traitement 6 à 10 |
| 8 pulvérisations/bouffées deux fois par jour |
12 pulvérisations/bouffées une fois par jour |
Avant l’usage, prière de lire les instructions complètes concernant la manipulation et l’emploi d'AservoMC EquihalerMC fourni dans le « Guide d’utilisation » ci-joint.
AservoMC EquihalerMC ne doit être administré que dans la narine gauche du cheval. Suivant l'insertion correcte et minutieuse, l'inhalateur AservoMC EquihalerMC devrait être parfaitement positionné dans la narine gauche. Un positionnement parfait est nécessaire pour que le cheval reçoive une dose complète d’AservoMC EquihalerMC.

Ne pas utiliser chez les chevaux ayant une hypersensibilité au ciclésonide ou à d’autres corticostéroïdes.

L’innocuité d’AservoMC EquihalerMC n’a pas été évaluée auprès de juments gestantes ou allaitantes. Des données cliniques et expérimentales ont démontré que l’administration de corticostéroïdes par voie orale ou par injection à des femelles durant le dernier trimestre de la gestation peut déclencher la première étape de la mise-bas ou une mise-bas prématurée suivie de dystocie, de la mort du foetus, de rétention placentaire et de métrite. De plus, l’administration de corticostéroïdes pendant la gestation peut avoir des effets tératogènes. Par conséquent, AservoMC EquihalerMC ne doit être employé chez des juments gestantes que si les bienfaits escomptés du traitement l’emportent sur les risques pour le foetus.
L’administration de corticostéroïdes peut aggraver une infection bactérienne, fongique ou virale existante. Avant de prescrire AservoMC EquihalerMC, il faut écarter la possibilité d’infections secondaires. Si elle est absolument nécessaire, l'administration de corticostéroïdes pour inhalation doit se faire avec prudence chez les chevaux présentant une infection évolutive des voies respiratoires. Si les signes cliniques ne s'améliorent pas ou s'aggravent malgré l'administration d'AservoMC EquihalerMC, il faut considérer une évaluation additionnelle du diagnostic.
Étant donné le risque d’exacerbation des signes cliniques de fourbure, les glucocorticoïdes doivent être employés avec prudence chez les chevaux ayant des antécédents de fourbure ou chez ceux qui présentent un risque plus élevé de cette affection.
Il faut utiliser ce produit avec prudence chez les chevaux atteints de néphrite chronique, d’un dysfonctionnement du lobe intermédiaire de l’hypophyse ou d’insuffisance cardiaque congestive.
L’utilisation concomitante d’autres anti-inflammatoires, tels que des antiinflammatoires non stéroïdiens (AINS) ou d’autres corticostéroïdes, doit se faire avec prudence. En raison du risque d’exposition systémique, l'utilisation concomitante d'AINS et de corticostéroïdes peut accroître le risque de toxicité gastro-intestinale, rénale et autre. Il convient de prévoir une période de sevrage adéquate avant d’administrer d'autres AINS ou corticostéroïdes.
Mises en garde: Garder hors de la portée des enfants. Ne pas utiliser chez l'humain. En cas d’inhalation accidentelle, consulter un médecin immédiatement et lui montrer la notice d’emballage ou l’étiquette de ce produit. Les personnes présentant une hypersensibilité connue au ciclésonide ou à l’un des excipients de ce médicament doivent éviter tout contact avec AservoMC EquihalerMC. Ne pas utiliser chez les chevaux destinés à la consommation humaine.

L’innocuité clinique d’AservoMC EquihalerMC a été évaluée dans le cadre d’une étude sur le terrain à répartition aléatoire, à double insu et contrôlée par excipient (dispositif identique renfermant l'excipient exempt de ciclésonide) de 10 jours, suivie d’une phase de prolongation en mode ouvert de 90 jours. Au cours de la Phase 1 de cette étude sur le terrain, 319 chevaux appartenant à des clients ou à une université ont reçu un traitement par AservoMC EquihalerMC ou par l'excipient. Suite à la Phase 1, 108 chevaux ont été admis à la Phase 2 au cours de laquelle ils pouvaient recevoir le traitement pendant un maximum de 3 mois additionnels. Tous les chevaux admis à la Phase 2 ont reçu AservoMC EquihalerMC. Trois cent dix-neuf chevaux (163 traités par ciclésonide et 156 témoins) de diverses races, âgés de 6 à 34 ans et pesant de 204 à 839 kg ont été inclus dans l’analyse de l’innocuité du produit.
Les réactions indésirables signalées à la Phase 1 sont indiquées au Tableau 1 et les réactions indésirables signalées lors de la Phase 2 sont fournies au Tableau 2. La réaction indésirable la plus couramment signalée était la toux, laquelle est survenue pendant ou immédiatement après l'inhalation (dans les groupes traités par AservoMC EquihalerMC et par l'excipient).
Des cas de leucocytose et/ou de neutrophilie sont survenus durant la Phase 1 chez plusieurs chevaux dans les deux groupes de traitement et chez huit chevaux pendant la Phase 2. Certains de ces chevaux présentaient également des signes cliniques d'infection concomitante, tels que de la fièvre, lesquels peuvent avoir contribué à la leucocytose.
Un cheval traité par AservoMC EquihalerMC a présenté de la fièvre et une leucocytose caractérisée par une augmentation des polynucléaires neutrophiles matures au Jour 10, laquelle n'était pas présente à la phase de sélection de l'étude. D'autres explications sont possibles pour un leucogramme de stress, telles que douleur causée par un abcès du sabot ou une mauvaise acceptation du dispositif, lesquelles peuvent avoir provoquer un stress lié aux procédures de l'étude.
À la Phase 1, trois chevaux traités par AservoMC EquihalerMC ont présenté une augmentation du taux sérique de sorbitol-déshydrogénase (SDH) au-delà de la plage de référence au Jour 10 (valeurs élevées : 12,4, 18,1 et 30,4 U/L); leur valeur initiale se trouvait à l'intérieur de la plage de référence (2 à 6 U/L). Aucun de ces chevaux ne présentait des signes attribuables à un taux élevé de SDH. Un cheval a également présenté une augmentation du taux sérique de gamma-glutamyltransférase (GGT) par rapport à la valeur initiale. Toutefois, le taux de GGT au début de l'étude était supérieur à la page de référence. Au Jour 40 de la Phase 2, puis au Jour 100, les taux de SDH et GGT chez ce cheval se trouvaient dans les limites de la normale. À la Phase 2, un cheval a présenté une élévation du taux de SDH (63,8 U/L) suivant la 6e série de traitement par AservoMC EquihalerMC. Ce cheval présentait des élévations du taux de phosphatase alcaline (269 U/L; plage de référence : 76 à 262 U/L), d'aspartate aminotransférase (511 U/L; plage de référence : 194 à 431 U/L) et de gamma-glutamyltransférase (128 U/L; plage de référence : 9 à 37 U/L). Les manifestations indésirables signalées chez ce cheval à divers points dans le temps au cours de l'étude comprenaient une toux, un écoulement nasal, une tachycardie et une hyperthermie. Suite à la visite au cours de laquelle un bilan sanguin anormal a été détecté, le propriétaire a décidé de retirer le cheval de l'étude (au Jour 75 environ).
À la Phase 1, un cheval a présenté un cas grave d'urticaires 30 minutes après l'administration de la quatrième dose d'AservoMC EquihalerMC. Ce cheval a été retiré de l'étude en raison de cette réaction indésirable.
Tableau 1 : Nombre (%) de chevaux ayant présenté des réactions indésirables à la Phase 1 de l'étude sur le terrain
| Réaction indésirable | AservoMC EquihalerMC (N=163) n (%) |
Excipient (N=156) n (%) |
|---|---|---|
| Toux | 27 (16.6) | 27 (17.3) |
| Écoulement nasal | 17 (10.4) | 17 (10.9) |
| Leucocytose et/ou neutrophilie | 10 (6.1) | 7 (4.5) |
| Éternuements | 5 (3.1) | 3 (1.9) |
| Irritation nasale/saignement nasal | 2 (1.2) | 3 (1.9) |
| Augmentation du taux sérique de sorbitol-déshydrogénase (SDH) | 3 (1.8) | 0 (0) |
| Urticaire | 1 (0.6) | 0 (0) |
* Un cas ou plus de la même réaction indésirable peut avoir été signalé chez un cheval.
Tableau 2 : Nombre (%) des chevaux ayant présenté des réactions indésirables à la Phase 2 de l'étude sur le terrain
| Réaction indésirable | AservoMC EquihalerMC (N=100) n (%) |
|---|---|
| Toux | 12 (12) |
| Écoulement nasal | 13 (13) |
| Leucocytose et/ou neutrophilie | 8 (8) |
| Irritation nasale/saignement nasal | 6 (6) |
| Fourbure | 3 (3) |
| Éternuements | 2 (2) |
| Augmentation du taux sérique de sorbitol-déshydrogénase (SDH) | 1 (1) |
* Un cas ou plus de la même réaction indésirable peut avoir été signalé chez un cheval.
Trois chevaux ont souffert de fourbure pendant la Phase 2. Deux de ces chevaux présentaient des antécédents de fourbure ou des signes physiques d'épisodes antérieurs de fourbure. Le troisième cheval n'avait pas d'antécédents de fourbure, a initialement reçu un traitement pour le muguet et a répondu au traitement conservateur en quelques semaines. Aucun diagnostic définitif de fourbure n'a été posé et le médecin vétérinaire ayant fait l'examen a conclu que l'environnement du cheval a contribué à l'apparition des signes cliniques.
À la Phase 1, une sensibilité nasale, un saignement, des croûtes dans la narine et une rougeur au niveau de la narine ont été signalés chez cinq chevaux dans les deux groupes de traitement. À la Phase 2, des cas d'épistaxis (2 chevaux), d'écoulement teinté de sang (1 cheval), de saignement nasal (1 cheval), de narine sensible (1 cheval) et de coloration rose vif des membranes muqueuses nasales (1 cheval) ont été signalés. Un cas d'épistaxis a été signalé 9 jours après l'administration de la dernière dose et un cas a été signalé au niveau de la narine droite moins de 24 heures suivant l'administration de la dernière dose. L'écoulement teinté de sang de la narine gauche a été signalé 11 jours après l'administration de la dernière dose. Ces signes cliniques semblables sont résumés sous la catégorie Irritation nasale/saignement nasal aux Tableau 1 et 2.

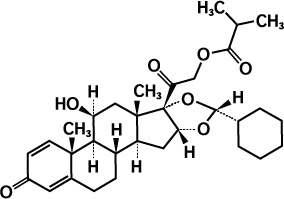
Le ciclésonide est un pro-médicament qui, une fois inhalé, est converti par voie enzymatique en un métabolite actif sur le plan pharmacologique, le désisobutyryl-ciclésonide (des-ciclésonide). L’affinité du des-ciclésonide pour les récepteurs des glucocorticoïdes est 120 fois plus élevée que celle de sa molécule mère et 12 fois plus élevée que celle de la dexaméthasone.
Les propriétés anti-inflammatoires du des-ciclésonide s’exercent par l’entremise d’un large éventail d’activités inhibitrices dirigées contre divers types de cellules, dont les mastocytes, les éosinophiles, les basophiles, les lymphocytes, les macrophages et les neutrophiles, et contre des médiateurs pro-inflammatoires tels que l’histamine, les éicosanoïdes, les leucotriènes et les cytokines. La formule développée du ciclésonide est la suivante:
Une étude pharmacocinétique menée en quatre périodes a été réalisée auprès de 6 chevaux de poids moyen et 6 chevaux de poids léger. Chaque cheval a reçu les schémas posologiques suivants :
Période 1 : 12 pulvérisations (4 116 mcg de ciclésonide/cheval) sous forme d'une inhalation unique;
Période 2 : 16 pulvérisations (5 488 mcg de ciclésonide/cheval) sous forme d'une inhalation unique;
Période 3 : 8 pulvérisations (2 744 mcg de ciclésonide/cheval) deux fois par jour pendant 4 jours consécutifs et une fois par jour le cinquième jour;
Période 4 : 8 pulvérisations (2 744 mcg de ciclésonide/cheval) deux fois par jour pendant 5 jours consécutifs, suivies de 12 pulvérisations (4 116 mcg de ciclésonide/cheval) une fois par jour pendant 5 jours.
Des échantillons de sang ont été prélevés avant et immédiatement après l’administration des doses, puis au bout de 5, 15 et 30 minutes et de 1, 2, 4, 6, 8, 10, 12 et 24 heures après une inhalation unique de 2 744, de 4 116 et de 5 488 mcg administrée aux périodes 1, 2 et 3, puis après l’administration de plusieurs doses de 2 744 et de 4 116 mcg aux périodes 3 et 4.
Des échantillons d’urine ont été recueillis à 24 et à 48 heures pendant la période 4. Les échantillons de plasma et d’urine ont été analysés à l’aide de méthodes de chromatographie en phase liquide et de spectrométrie de masse validées afin de déterminer les concentrations de ciclésonide et de des-ciclésonide qu’ils contenaient.
Le ciclésonide a été rapidement métabolisé en des-ciclésonide, des concentrations quantifiables de ce métabolite ayant été décelées chez la plupart des animaux 5 minutes après l’administration d’une dose. Les concentrations urinaires de ciclésonide et de des-ciclésonide étaient inférieures au seuil de quantification 24 et 48 heures après l’administration de doses de 2 744 mcg deux fois par jour pendant 5 jours, suivies de doses de 4 116 mcg une fois par jour pendant 5 jours. Le Tableau 3 résume les résultats de l’analyse pharmacocinétique du des-ciclésonide chez les chevaux de poids moyen et de poids léger (ajustés en fonction du poids vif) après l’inhalation de doses de 2 744 mcg de ciclésonide deux fois par jour pendant 5 jours, suivies de doses de 4 116 mcg de ciclésonide une fois par jour pendant 5 jours.
Tableau 3 : Paramètres pharmacocinétiques moyens (± écart-type; ÉT) obtenus pour le des-ciclésonide après l’inhalation de doses de 2 744 mcg de ciclésonide deux fois par jour pendant 5 jours, suivies de doses de 4 116 mcg de ciclésonide une fois par jour pendant 5 jours.
| Paramètre | Dose (mcg) |
Cheval de poids moyen | Cheval de poids léger |
| Cmax (pg/mL) | 2744 | 232.67 (40.89) | 297.00 (92.0) |
| Tmax (h)† | 2744 | 0.50 (0.5-0.5) | 0.50 (0.25-1.0) |
| Dernière ASC (h*pg/mL) | 2744 | 824.26 (81.77) | 1087.07 (137.85) |
| T½ (h) | 2744 | 5.00 (1.06) | 5.94 (2.12) |
| Cmax (pg/mL) | 4116 | 297.50 (104.62) | 493.00 (248.27) |
| Tmax (h)† | 4116 | 0.50 (0.5-1.0) | 0.50 (0.5-1.0) |
| Dernière ASC (h*pg/mL) | 4116 | 1011.39 (291.72) | 1550.31 (690.02) |
| T½ (h) | 4116 | 6.08 (2.42) | 9.75 (4.20) |
Cmax = concentration plasmatique maximale
†Tmax = temps écoulé avant l’obtention de la concentration maximale; médiane (plage)
Dernière ASC = aire sous la courbe de la concentration en fonction du temps écoulé avant l’obtention de la dernière concentration mesurable
T½ = demi-vie
L’exposition au des-ciclésonide était plus élevée et plus variable chez les chevaux de poids léger que chez ceux de poids moyen. Après une seule administration du médicament, chez les deux types de chevaux, une hausse plus que proportionnelle à la dose de la Cmax et de la dernière ASC du des-ciclésonide a été observée lors de l’augmentation de la dose de 2 744 à 4 166 mcg. Une accumulation minime de des-ciclésonide a été constatée après l’inhalation de doses de 2 744 mcg de ciclésonide deux fois par jour pendant 5 jours, suivies de doses de 4 116 mcg de ciclésonide une fois par jour pendant 5 jours.

Innocuité chez les animaux: Au cours d’une étude sur l'innocuité de 1 mois menée chez l’animal cible, 32 chevaux adultes en santé (16 juments et 16 hongres) ont été affectés à 1 des 4 groupes de traitement, chacun d’eux comptant 8 chevaux. Chaque groupe de traitement comprenait 6 chevaux de poids moyen (de 371,9 à 539,8 kg; moyenne de 477,0 kg) et 2 chevaux de poids léger (de 121,5 à 260,5 kg; moyenne de 179,5 kg). Les chevaux de poids léger ont expressément été recrutés aux fins d’évaluation de l’innocuité de la plus forte dose, en mg de ciclésonide par kg de poids vif.
Les chevaux ont été répartis au hasard en quatre groupes et ont tous reçu pendant 30 jours (soit le triple de la durée normale du traitement) un multiple différent de la dose thérapeutique au moyen de l’inhalateur nasal, soit respectivement 0x (excipient), 1x, 2x et 3x la dose thérapeutique de ciclésonide. Chaque groupe de traitement comprenait 8 chevaux au total, soit six chevaux de poids moyen (3 mâles et 3 femelles) et deux chevaux de poids léger (1 mâle et 1 femelle). Les chevaux du groupe témoin ont reçu le même nombre de bouffées que ceux du groupe traité par la plus forte dose (3x la dose thérapeutique), mais l’inhalateur nasal ne contenait qu’un excipient.
Un écoulement nasal léger, mucoïde ou séromucoïde, a été observé dans tous les groupes, y compris les témoins, et n’a pas semblé s’aggraver après le traitement. En général, dans les groupes 0x, 2x et 3x, une augmentation du nombre d’espèces fongiques isolées a été constatée au 30e jour de l’étude. Toutefois, ce résultat pourrait être attribuable à l’environnement et au séjour prolongé des chevaux à l’intérieur de l’écurie et en contact direct avec d’autres chevaux plutôt qu’au traitement au moyen de l’inhalateur. Après le traitement, des espèces du genre Candida ont été isolées chez un seul cheval, celui-ci ne présentant aucune anomalie clinique. La posologie était destinée à imiter la posologie biquotidienne pendant les 15 premiers jours, puis la posologie quotidienne pendant la seconde moitié de l'étude.
Pendant l’étude, une asymétrie faciale et une déviation des naseaux ont été observées chez deux chevaux traités par le ciclésonide. L’anomalie s’était résorbée chez l’un d’eux avant la fin de l’étude. Aucun autre problème connexe n’a été relevé et aucune constatation de nature pathologique n’a été corrélée à cette anomalie.
Les taux de cortisol ont été mesurés et utilisés comme marqueur pour détecter une suppression de l’axe hypothalamo-hypophyso-surrénalien (HHS) imputable à l’action générale des corticostéroïdes. Le 14e jour (fin de la période de traitement biquotidien), deux chevaux de poids léger traités par une triple dose (3x) de ciclésonide ont obtenu des valeurs inférieures (16,3 et 14,1 ng/mL) à toutes celles enregistrées pendant l’étude (y compris celles mesurées au départ et chez les témoins) et aux valeurs situées dans les limites de la normale (de 27,6 à 73,2 ng/mL). Le 29e jour, le taux de cortisol d’un des deux chevaux s’était normalisé (55,9 ng/mL), tandis que celui de l’autre cheval restait faible (15,9 ng/mL). Ces baisses du taux de cortisol chez les chevaux de plus petite taille du groupe ayant reçu la dose maximale pourraient s’expliquer par la suppression du cortisol consécutive à l’administration du corticostéroïde. Cependant, la portée de cette observation sur le plan clinique est inconnue, car ni l’un ni l’autre des chevaux en cause n’a présenté de manifestations indésirables imputables au ciclésonide.
Les taux de sorbitol déshydrogénase (SDH) n'étaient pas statistiquement différents entre les groupes traités par ciclésonide et le groupe témoin. Toutefois, un cheval témoin (Jour 14, SDH 13,6 U/L), un cheval de poids léger du groupe de traitement 2x (Jour 29, SDH 9,3 U/L) et deux chevaux de poids léger du groupe de traitement 3x (Jour 29, SDH 10,4 et 8,8 U/L) avaient des valeurs de SDH supérieures à la plage de référence (plage de référence 1-8 U/L). Ces valeurs ne correspondaient pas aux augmentations d'autres enzymes hépatiques et les chevaux sont restés cliniquement normaux.

Dans le cadre d'une étude sur le terrain multicentrique, à répartition aléatoire, à double insu et contrôlée par excipent, 320 chevaux ont été répartis au hasard pour recevoir AservoMC EquihalerMC, le produit vétérinaire à l'étude contenant l'ingrédient actif ciclésonide, ou le produit témoin consistant en un dispositif d'inhalation identique contenant un excipient exempt de ciclésonide. Cette étude comportait deux phases, et 108 des 320 chevaux recrutés ont participé aux Phases 1 et 2 de l'étude.
La Phase 1 de l'étude consistait en une évaluation à double insu sur 10 jours de l'efficacité et de l'innocuité d'AservoMC EquihalerMC par rapport à l'excipient dans la prise en charge des signes cliniques associés à l'asthme équin grave chez des chevaux appartenant à des clients et à des universités dans des conditions de terrain.
À la Phase 1, il était interdit d’apporter la moindre modification au milieu de vie des chevaux. Au terme de la Phase 1, 108 chevaux sont passés à la Phase 2 menée en mode ouvert de 90 jours dans le but d'évaluer l’innocuité d'AservoMC EquihalerMC utilisé de façon répétée.
À la Phase 1, un score clinique pondéré a été calculé pour évaluer l’admissibilité des sujets et la réussite du traitement au terme de l’étude. Ce score clinique pondéré a été calculé à partir de neuf paramètres cliniques (fréquence respiratoire, écoulement nasal, battement des ailes du nez, contraction des muscles abdominaux, bruits trachéaux, bruits bronchiques, crépitements, sifflements et toux) avec un score maximal de 23. Pour être admissibles, les chevaux devaient avoir un score clinique pondéré ≥11 (voir le Tableau 4), peser au moins 200 kg, avoir reçu un diagnostic d'asthme équin grave avec observation d'au moins un signe clinique pendant 14 jours ou plus avant l'admission à l'étude, avoir des antécédents d'au moins deux épisodes antérieurs de respiration difficile au repos et avoir des antécédents d'amélioration avec un traitement approprié (par exemple, administration de glucocorticoïdes, administration de bronchodilatateurs et/ou changement d'environnement). Deux cent cinquante-huit chevaux (134 sous AservoMC EquihalerMC et 124 témoins) ont été inclus dans l'analyse de l'efficacité. Les chevaux qui n'ont pas reçu la dose complète après leur admission à l'étude en raison du refus du cheval d'accepter le dispositif ont été inclus dans l'analyse en tant qu'échecs de traitement.
Tableau 4: Score clinique pondéré
| Paramètre | Score: Description |
|---|---|
| Fréquence respiratoire (respirations/minute) | 0: <16 bpm 1: 16-20 rpm 2: 21-25 rpm 3: 26-30 rpm 4: >30 rpm |
| Écoulement nasal | 0: Aucun 1: Séreux 2: Muqueux 3: Muco-purulent |
| Battement des ailes du nez | 0: Aucun 1: Présent |
| Contraction des muscles abdominaux | 0: Aucune 1: Léger mouvement de l'abdomen et/ou du thorax et/ou de l'anus (avec ou sans soulèvement perceptible) 3: Mouvement marqué de l'abdomen et/ou du thorax et/ou de l'anus (avec ou sans soulèvement perceptible) |
| Bruits trachéaux | 0: Normaux 1: Augmentation en intensité 3: Mouvement du mucus |
| Bruits bronchiques | 0: Normaux 2: Bruits ventraux et/ou dorsaux audibles |
| Crépitements | 0: Aucune 2: Présents |
| Respiration sifflante | 0: Aucune 2: Présente |
| Toux | 0: Aucune 1: Provoquée par une pression modérée sur le larynx (à vérifier uniquement en l'absence de toux intermittente ou paroxystique) 2: Intermittente 3: Paroxystique |
Le traitement était considéré comme étant une réussite si le score clinique pondéré avait diminué d'au moins 30 % entre le Jour 0/1 et le Jour 10, et s’il se chiffrait à 14 ou moins au Jour 10. Dans cette étude, 52 % des chevaux traités par AservoMC EquihalerMC, comparativement à 33 % des chevaux traités par l'excipient, ont obtenu un traitement réussi (p=0,0187), ce qui démontre l'efficacité d'AservoMC EquihalerMC (solution pour inhalation de ciclésonide) dans la prise en charge des signes cliniques associés à l'asthme équin grave chez les chevaux.
La Phase 2 a fourni des informations sur l'innocuité et l'utilisation sur le terrain de traitements répétés de 10 jours dans les conditions d'utilisation, y compris l'utilisation en association avec d'autres stratégies thérapeutiques appropriées. Au cours de la Phase 2, 88 chevaux ont terminé la période complète de l'étude de 100 jours. La raison la plus souvent évoquée pour l'abandon de l'étude était l'absence d'efficacité perçue (n=7). Un traitement de 10 jours par AservoMC EquihalerMC devait être prescrit aux chevaux présentant un score clinique pondéré de ≥9. Huit des 108 chevaux n'ont pas reçu de dispositifs d'inhalation additionnels. Parmi les 100 chevaux admissibles à la répétition du traitement, 52 (52 %) étaient admissibles pour recevoir une à trois séries additionnelles de traitement. Deux des chevaux qui avaient reçu AservoMC EquihalerMC au cours de la Phase 1 ont reçu neuf séries additionnelles de traitement à la Phase 2, pour une exposition totale à AservoMC EquihalerMC de 100 jours. Vingt-trois (23 %) chevaux ont reçu sept à neuf séries de traitement au cours de la Phase 2. L'administration de médicaments concomitants et l'apport de changements environnementaux en vue de la prise en charge globale de l'asthme équin grave étaient permis à la Phase 2. Les médicaments concomitants les plus souvent prescrits comprenaient les bronchodilatateurs et les antihistaminiques. Des antimicrobiens systémiques ont été prescrits à six chevaux dont les signes cliniques d'asthme équin grave n'étaient pas bien maîtrisés ou s'aggravaient malgré l'administration continue d'AservoMC EquihalerMC ou si des signes cliniques d'infection étaient présents. Deux chevaux ont reçu du dexaméthasone à l'abandon prématuré de l'étude étant donné que leur maladie n'était pas bien maîtrisée. Les changements environnementaux les plus souvent apportés au cours de la Phase 2 comprenaient le trempage ou le traitement à la vapeur du foin, le remplacement de la source de fourrage par des cubes de foin ou un produit d'ensilage, le changement de la source de foin (y compris l'arrêt de l'accès aux balles rondes) et l'augmentation du temps passé au pâturage par rapport au temps passé dans l'écurie.

Prière de revoir le Guide d'utilisation avec les propriétaires de chevaux pour s'assurer que son contenu est bien compris. Le Guide d'utilisation comprend des instructions importantes concernant la manipulation et l'emploi appropriés d'AservoMC EquihalerMC. La démonstration de l'activation, de l'administration et de l'entreposage d'AservoMC EquihalerMC aux propriétaires de chevaux est fortement recommandée.

Entreposer à une température entre 15 et 30 °C. Protéger du gel. L'inhalateur doit être utilisé dans les 12 jours suivant son activation.

AservoMC EquihalerMC est présenté sous forme d'un inhalateur où est déjà insérée une cartouche formée d’un contenant en plastique serti dans un cylindre d’aluminium et qui renferme 140 pulvérisations de solution pour inhalation.
Boehringer Ingelheim Santé Animale Canada Inc.
5180 South Service Road
Burlington, Ontario L7L 5H4
AservoMC et EquihalerMC sont des marques de commerce de Boehringer Ingelheim Vetmedica GmbH, utilisées sous licence.
Dernière révision : 04/2020

Veuillez lire attentivement les instructions ci-dessous avant d’utiliser AservoMC EquihalerMC (solution de ciclésonide pour inhalation) pour la première fois. Ces instructions peuvent également être consultées à l’adresse URL info.equi-haler.com ou au moyen du code QR ci-joint. L’inhalateur AservoMC EquihalerMC est destiné aux chevaux. Il contient suffisamment de solution pour inhalation pour assurer un traitement complet de 10 jours. Il s'agit d'un inhalateur à usage unique qui doit être jeté 12 jours après son activation.

L'inhalateur AservoMC EquihalerMC ne peut être utilisé que de la main gauche. Tout en tenant l’inhalateur AservoMC EquihalerMC avec la main gauche, tenir et maîtriser le cheval de la main droite.

Retirer l’inhalateur AservoMC EquihalerMC de la boîte.
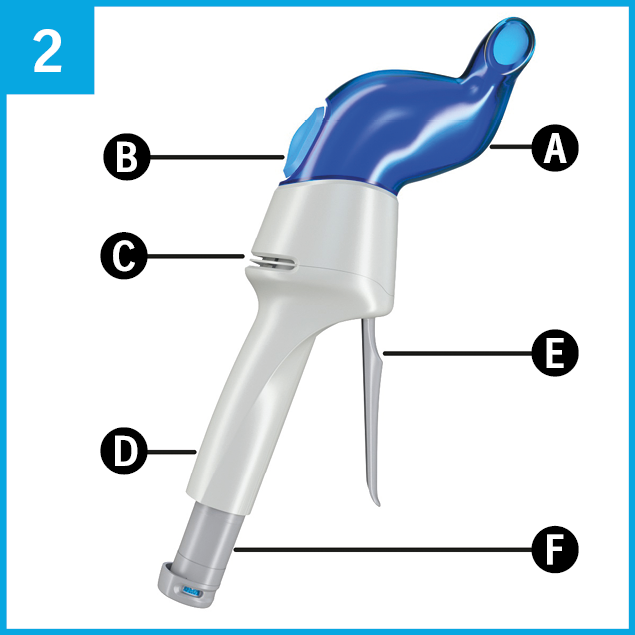
Se familiariser avec l'inhalateur.
AservoMC EquihalerMC comprend:
A Embout nasal
B Indicateur de respiration
C Prise d’air
D Manche
E Manette d’amorçage et de libération
F Poinçon avec indicateur de remplissage
Les prochaines sections expliquent en détail comment activer, préparer, administrer, nettoyer et entreposer AservoMC EquihalerMC.

Activer l’inhalateur AservoMC EquihalerMC une seule fois avant de l’utiliser pour la première fois. L'inhalateur doit être utilisé dans les 12 jours suivant son activation. Indiquer la date correspondant à 12 jours après la date d'activation sur l'étiquette du dispositif à côté de « Utiliser avant _______ ».

Pour activer AservoMC EquihalerMC, enfoncer le poinçon F dans le manche de l’inhalateur. Sans appuyer sur la manette E, placer la main droite sous le poinçon de couleur gris foncé F…
Ne pas tenter de retirer le poinçon; le retrait causera des dommages significatifs au dispositif..
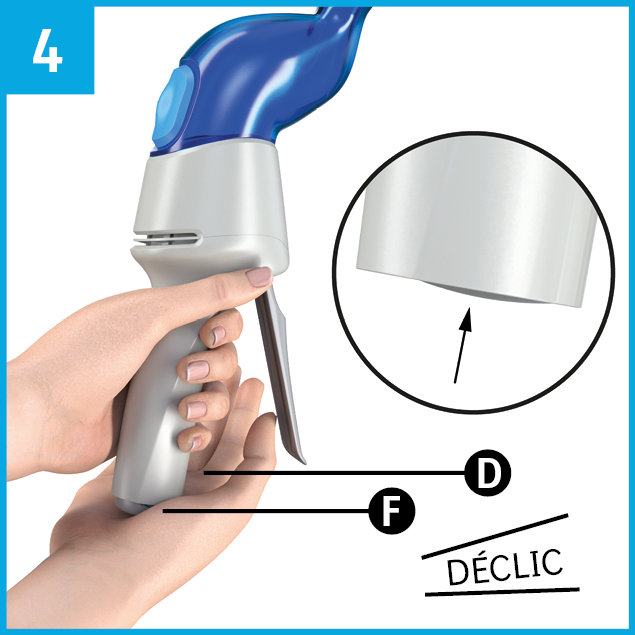
... puis enfoncer fermement et complètement le poinçon F dans le manche D jusqu’à ce qu'un déclic se fasse entendre.
Une résistance initiale se fera sentir à l'activation de l'inhalateur. Continuer à exercer la force nécessaire jusqu'à ce que le poinçon disparaisse complètement dans le manche D et qu'il ne soit plus visible.
L’inhalateur AservoMC EquihalerMC est maintenant activé et prêt à être utilisé.
Exercer une force excessive pourrait endommager le dispositif.

Il est essentiel de préparer l’inhalateur AservoMC EquihalerMC afin d’assurer l’exactitude de la dose initiale. L'étape de préparation n’est effectuée qu’une seule fois et consiste en trois (3) actionnements (décrits ci-dessous). L'aérosol sera entièrement visible après le troisième actionnement.
Lorsque la manette E d'AservoMC EquihalerMC est pressée pour la première fois, la partie inférieure du poinçon avec l'indicateur de remplissage F sera à nouveau visible. Ne pas repousser le poinçon dans le manche du dispositif.

Chaque pulvérisation/bouffée consiste en deux étapes pour assurer la libération du médicament (une bouffée). Ces étapes sont les suivantes (illustrations 5 à 8):

Tenir l’inhalateur AservoMC EquihalerMC à la verticale de la main gauche.

Étape 1: Appuyer sur la manette E jusqu’à ce qu’elle touche le manche et qu’un déclic se fasse entendre.
Relâcher la manette E pour qu’elle reprenne sa position initiale.

L'afficheur de l'indicateur de remplissage dans le poinçon est partiellement couvert par une bande rouge.
Ne pas entreposer l'inhalateur si l'indicateur de remplissage est rouge tel qu'illustré à l'étape 7 ci-haut.
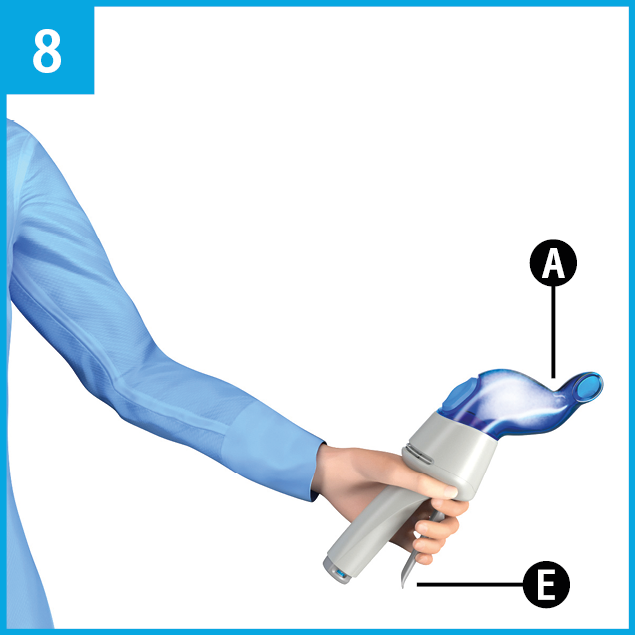
Étape 2: Appuyer de nouveau sur la manette E, mais légèrement cette fois-ci, jusqu’à ce qu'un déclic se fasse entendre. Le déclic se fera entendre après un léger mouvement de la manette; l'aérosol sera alors libéré dans l'embout nasal A.
À cette étape-ci, ne pas appuyer complètement sur la manette.
Relâcher immédiatement la manette et lui permettre de reprendre sa position initiale. L'indicateur de remplissage sera maintenant entièrement visible et la bande rouge ne sera plus visible. L'indicateur de remplissage indique le pourcentage de solution qui reste dans le dispositif.
Remarque:
Si le poinçon est accidentellement repoussé à l’intérieur du manche, il reprendra automatiquement la bonne position la prochaine fois que l'inhalateur AservoMC EquihalerMC sera activé.

L'administration ne doit se faire que dans la narine gauche. L'embout nasal doit demeurer dans la narine pendant la durée totale nécessaire pour l'administration de 8 ou 12 pulvérisations/bouffées. Si l'embout nasal glisse hors de la narine pendant l'administration, l'insérer à nouveau dans la narine.

Tenir l’inhalateur AservoMC EquihalerMC de la main gauche. S'assurer que la prise d’air C n’est pas obstruée.
Se tenir à la gauche du cheval de façon à ce que sa tête soit appuyée contre l'épaule droite de la personne qui administre le médicament.

Introduire délicatement l’embout nasal A dans la narine gauche du cheval, puis tourner l’inhalateur doucement pour qu’il soit à la verticale.

S'assurer que l’embout nasal est bien inséré dans la fosse nasale.

Observer le mouvement de l’indicateur de respiration B:
Lorsque le cheval inspire, l’indicateur se creuse (illustration 12a).
Lorsque le cheval expire, l’indicateur se gonfle (illustration 12b).
Le moment optimal pour libérer le médicament est au début d’une inspiration, lorsque l’indicateur de respiration B commence à se creuser (illustration 12a).
Remarque: Pour que l’indicateur de respiration fonctionne bien, il faut que l’embout nasal A soit correctement placé et parfaitement ajusté dans la narine du cheval.
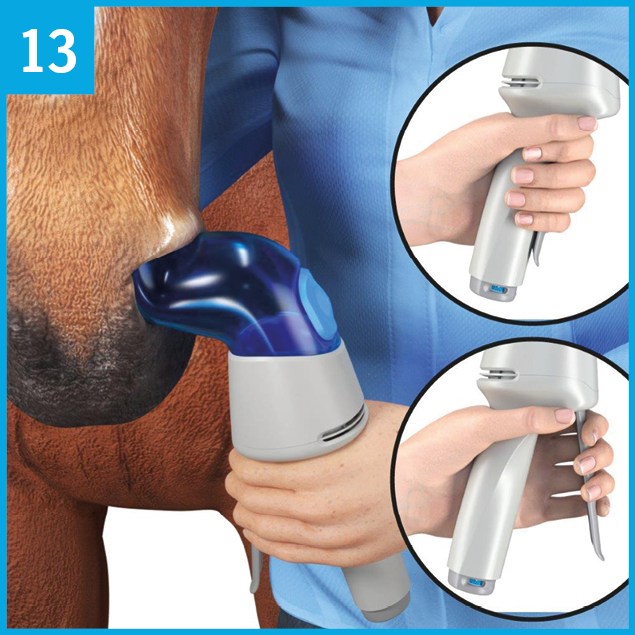
Le traitement peut commencer dès que l'inhalateur AservoMC EquihalerMC est bien inséré. Chaque pulvérisation/bouffée doit être effectuée en suivant les deux étapes expliquées précédemment aux illustrations 6, 7 et 8.
Administrer 8 actionnements/bouffées deux fois par jour pendant les cinq premiers jours.
Par la suite, administrer 12 actionnements/bouffées une fois par jour pour les cinq prochains jours, pour une durée totale de traitement de 10 jours.
| La durée totale du traitement est de 10 jours | |
| Jours de traitement 1 à 5 |
8 pulvérisations / bouffées deux fois par jour |
| Jours de traitement 6 à 10 |
12 pulvérisations / bouffées une fois par jour |


L’indicateur de remplissage indique le pourcentage approximatif de pulvérisations/bouffées qui restent dans l’inhalateur. Il devrait indiquer 100 % avant la première utilisation, c.-à-d. une fois que l'inhalateur AservoMC EquihalerMC est prêt à l'emploi.
Après l'activation, entreposer l'inhalateur avec l'indicateur de remplissage à la position bleue/blanche seulement; ne pas ranger l'inhalateur avec un indicateur de remplissage à la position rouge.

L'afficheur de l'indicateur de remplissage ne change qu'après plusieurs pulvérisations/bouffées.
Il faut noter que l'indicateur de remplissage ne sert que de guide.
Une fois toutes les doses ou traitements administrés, l'afficheur devrait être à la position 0 %. L'inhalateur ne doit alors plus être utilisé. Toutefois, le manche fonctionnera toujours.
La documentation manuelle des doses administrées est encouragée.
Si l'indicateur de remplissage ne semble pas fonctionner, il est important de continuer à traiter le cheval tel que prescrit.
En outre, si la période de traitement de 10 jours prescrite est terminée, ne pas continuer à utiliser l'inhalateur même si l'indicateur de remplissage affiche plus de 0 %. Si le cheval présente toujours des signes cliniques, communiquer avec le médecin vétérinaire.

Le nettoyage n'est nécessaire qu'au besoin seulement. Essuyer l'extérieur de l'embout nasal avec un linge humide pour éliminer toute substance étrangère, au besoin.
Le nettoyage de la surface interne de l'embout nasal n'est pas nécessaire sauf si des sécrétions nasales ou autres substances étrangères y adhèrent. S'il est nécessaire de nettoyer la surface interne, détacher l’embout nasal et le rincer tel que décrit ci-dessous.
Avant de nettoyerl’inhalateur, s'assurer que l’indicateur de remplissage est bleu/blanc. S’il est rouge, appuyer sur la manette E jusqu’à ce qu'un déclic se fasse entendre. Cette précaution permettra d'assurer que le médicament n'est pas libéré accidentellement. Pour éviter d’inhaler le produit, tenir l’inhalateur loin de vous.

Tourner et détacher l’embout nasal A du manche D.
Entreposer le manche dans un endroit propre et sec.

Rincer l’embout nasal A à l’eau courante propre seulement. Ne pas utiliser de brosses ou de produits de nettoyage.
L'embout nasal ne doit pas être mis au lave-vaisselle.

Laisser l’embout nasal A sécher à l’air libre et à la verticale pendant au moins 4 heures.
Ne pas l’essuyer avec un linge ni utiliser de chaleur pour le sécher.
Ne pas utiliser d’appareils comme un séchoir à cheveux, un four à micro-ondes ou un élément de chauffage.

Une fois que l’embout nasal A est sec, le raccorder à nouveau au manche D en le poussant fermement et en le tournant légèrement jusqu’à ce qu’il soit bien en place.
L’embout nasal A ne s’enclenche que s’il est placé correctement et qu’il s’ajuste parfaitement au manche.
L’inhalateur AservoMC EquihalerMC est maintenant prêt pour la prochaine utilisation.

Après l'activation de l'inhalateur, entreposer l'inhalateur avec l'indicateur de remplissage à la position bleue/blanche seulement; ne pas ranger l'inhalateur avec un indicateur de remplissage à la position rouge. Entreposer à une température de 15 à 30 °C. Protéger du gel. Utiliser dans les 12 jours suivant l’activation.